Enfermaria 33 da Santa Casa de Misericordia do Rio de Janeiro
CENTRO DE NEOPLASIA TROFOBLASTICA GESTACIONAL
RIO DE JANEIRO / BRASIL
INTRODUÇÃO
Neoplasia Trofoblástica Gestacional (NTG) são blastomas originários do tecido de revestimento das vilosidades coriais (trofoblasto) que apresentam crescimento anárquico, do ponto de vista histopatológico e suscetíveis a exibir alterações degenerativas no estroma. É característica mais conspícua das neoplasias trofoblástica gestacionais, a de apresentar marcador biológico – hormonial – a fração beta das gonadotrofinas coriônicas humanas (β hCG).
Conquanto frondosa a literatura acerca do diagnóstico de NTG, numerosas instituições têm se dedicado em buscar novos meios de efetuar-se essa etapa fundamental na terapêutica. Emergiu, a partir daí técnicas que vão desde os conhecidos exames anatomopatológico, passando pela imagem ultra-sonográfica até a avaliação da ploidia tumoral do DNA, quer determinada pela Citometria de Fluxo, quer pela Citometria Digital, como um importante instrumento a diagnosticar as neoplasias trofoblásticas gestacionais, além de monitorar a resposta terapêutica aos diversos tratamentos propostos para a NTG.
Entretanto, sendo clínica e praticamente inexeqüível, em nosso meio, a aplicação do diagnóstico citogenético e em muitos lugares até mesmo patológico da NTG, cumpre ressaltar a importância dos aspectos clínicos enquanto excelente ferramenta para o diagnóstico da NTG, que conta tão somente com o tirocínio clínico do trofoblasta aliado a uma minuciosa anamnese das pacientes com gestações molares.
Uma vez efetuado o diagnóstico de NTG, mister que a conduta seja o encaminhamento da paciente para os centros de referência no tratamento desta doença. Nesses centros, com uma atualização constante acerca destes blastomas, novas condutas são implementadas mediante o estadiamento clínico proposto para a doença, consoante os mais modernos conceitos de acompanhamento sintomatológico, modo de esvaziamento uterino, dosagem de gonadotrofinas, além da preocupação com o futuro reprodutivo das pacientes molares e de suporte psicológico trazendo um enfoque muito mais holístico no seguimento, fatores estes que dificilmente encontrar-se-ão, com excelência, em hospitais que não os de referência.
Belfort avalia que “a Neoplasia trofoblástica gestacional deveria ser considerada, de fato, problema social tal a sua prevalência no Brasil e no mundo subdesenvolvido, ao trazer para a família e sociedade problemas de tal envergadura que somente as instituições seriam capazes de absorver e de resolver. É a realidade, entretanto, bem diversa, vez que as instituições ignoram ou desconhecem a patologia e a sociedade em absoluto se sensibiliza com o drama individual”.
Por fim, e mediante o exposto, a magnitude deste tema está em ser a Neoplasia Trofoblástica Gestacional uma afecção freqüente em nosso meio, de fácil diagnóstico, porém muitas vezes diagnosticada, tratada e até acompanhada de maneira incoerente quando fora de centro especializados, causando sofrimento às pacientes já tão sensibilizadas por sua doença e fracasso gestacional, interferindo em sua libido, em seu potencial reprodutivo futuro e, quando não, levando à morte.
FUNDAMENTOS TEÓRICOS
As molas hidatiformes constituem alteração de interesse simultaneamente clínico e epidemiológico, mercê das complicações de amplo espectro a elas associadas, indo da doença trofoblástica residual ao coriocarcinoma e por estarem vinculadas a diversos e singulares fatores etiológicos.
Histórico
A neoplasia trofoblástica gestacional remonta7 à época helênica da Medicina. Pelos idos de 140 a.C. Hipócrates e seus discípulos faziam alusão às vesículas eliminadas por determinadas mulheres.
Foi, entretanto Aécio de Amida (232 – 365 d.C.), que, no século VI, objetivamente descreveu a mola hidatiforme rotulando-a de hydrops uteri.
Ambrósio Paré (1539 – 1590) pensou que cada vesícula eliminada fosse um pequeno embrião.
Por ocasião do fim do século XVIII e início do século XIX, J. A. Goze lançou a hipótese sobre a teoria parasitária da mola hidatiforme ao estudar o útero de uma lebre prenha e cheio de parasitos, fez analogia à mesma causa para a mola humana, levando Croquet, em 1812, a classificar as hidátides no sistema zoológico como “Acephalocystes racemosa”.
Coube a Félix Jacob Marchand em 1895 a comprovação de que a mola hidatiforme originava-se exclusivamente do trofoblasto e não da decídua ou do estroma.
A primeira observação objetiva da malignização da mola hidatiforme foi dada por Sänger, em 16 de julho de 1888, comunicando o fato à Sociedade de Ginecologia e Obstetrícia de Leipzing.
No contexto brasileiro, não pode ficar à parte a implantação do primeiro do Centro de Neoplasia Trofoblástica Gestacional brasileiro pelo Prof. Paulo Belfort, coordenador do Centro de Neoplasia Trofoblástica Gestacional, cujo trabalho, dedicação e conhecimento o fizeram referência internacional nestes blastomas.
Formas clínicas
Em 1977, Vassalikos, Riotton e Kajii de Genebra, Suíça fizeram a comunicação original da descrição de duas formas clínicas de mola hidatiforme: “parcial” e “completa”, suscetíveis a ser identificadas por seus aspectos anatomopatológicos, citogenéticos e evolutivos.
Assim descrevem, os autores, as peculiaridades das duas molas.
MOLA PARCIAL
Macroscopia. Caracteriza-se pela presença de pequenas vesículas hidrópicas de até 5mm, porém, em alguns exemplos quando a prenhez evolve até a sua metade, alcançam até 20mm. Em meio a essas vesículas há tecido trofoblástico normal, existência de feto e/ou âmnio, conforme mostra a Figura 1.
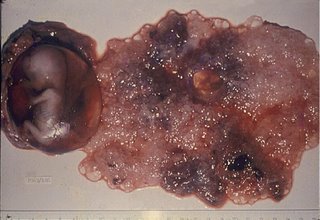
Figura 1. Aspetos macroscópicos da mola parcial. Observar vesícula na placenta junto com embrião e anexos. Imagem do Centro de Neoplasia Trofoblástica Gestacional da 33ª Enfermaria (Maternidade) da Santa Casa da Misericórdia do Rio de Janeiro.
Histopatologia. As vilosidades hidrópicas exibem hiperplasia moderada, sem anaplasia celular. São sistematicamente evidenciadas vilosidades normais nas quais, quando preservadas, está consignada a presença de vasos, como mostra a figura 2. Não faltam, de hábito, fragmentos de membrana. Funcionando a circulação vilosa encontramos nos vasos sangue fetal nucleado.
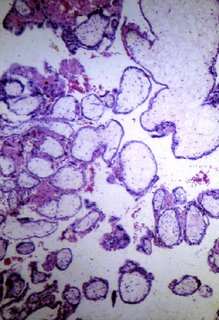
Figura 2. Aspetos microscópicos da mola parcial. Imagem do Centro de Neoplasia Trofoblástica Gestacional da 33ª Enfermaria (Maternidade) da Santa Casa da Misericórdia do Rio de Janeiro.
Citogenética. Predomina casos com anomalia cromossomial incluindo trissomias, triploidias e tetraploidias.
MOLA COMPLETAMacroscopia. Feto, cordão e membrana sempre ausentes. As vilosidades de primeiro trimestre medem entre 1 e 8mm de diâmetro e aquelas de segundo trimestre, entre 1,5 e 20mm não sendo jamais anotada a presença de vilosidades normais.

Figura 3. Macroscopia da mola completa. Observar as vesículas hidrópicas de permeio à placenta. Imagem do Centro de Neoplasia Trofoblástica Gestacional da 33ª Enfermaria (Maternidade) da Santa Casa da Misericórdia do Rio de Janeiro.
Histopatologia. O trofoblasto – sincício e citotrofoblasto – mostra acentuada e sistemática hiperplasia com anaplasia celular. Vêem-se, em certos exemplos, vilosidades atróficas e hiperplasia trofoblástica discreta. Excepcionalmente evidenciam a presença de capilares e, nesses raros casos, os vasos semelham àqueles existentes nas vilosidades de ovos muitos jovens. Quando presentes vasos, neles nunca se visualizam glóbulos vermelhos fetais nucleados. Quando preservado, o estroma da vilosidade semelha mesênquima imaturo. A presença de fragmentos de âmnio e notada.

Figura 4. Microscopia da mola completa. Notar áreas de cisternas centrais que ocupam quase toda a intimidade do trofoblasto avascular. Imagem do Centro de Neoplasia Trofoblástica Gestacional
Citogenética. O cariótipo é usualmente feminino: 46XX, raramente 46XY.
Sintomatologia As manifestações clínicas nas duas variedades de mola são essencialmente semelhantes. Discrepam pela intensidade de sinais e sintomas a mola parcial exibindo-os de forma atenuada e pela presença de feto, que pode estar vivo ou morto. São repassados em revista, a seguir, os principais elementos que denunciam a mola hidatiforme.
Sangramento vaginal.
É quase constante, podendo acompanhar-se ou não de dor tipo cólica sendo, entretanto, indolor maioria das vezes.Esteve presente em 97% dos casos relatados por Goldstein & Berkowitz9, em 89% dos 320 casos estudados por Curry10 et al., em 94% dos 200 casos acompanhados por Kohorn e em 99% dos 134 casos estudados por Belfort et al.
Inicia-se, pelo geral, entre a 4ª e a 16ª semana de amenorréia, em mais de 95% das pacientes. Entre um e outro episódio hemorrágico elimina-se secreção serosa clara, de odor sanioso, decorrente da liquefação dos coágulos intra-uterinos.
Em raras oportunidades, vesículas podem ser eliminadas, o que selará o diagnóstico. Goldstein & Berkowitz referem que 28% de suas pacientes apresentaram valores de hemoglobina inferiores a 10g. Com efeito, se o sangramento for prolongado e repetido, poderá levar a paciente a quadro de anemia e, eventualmente, de choque.
Aumento de volume uterino.
Mostra-se o útero grande para a idade gestacional na mola completa, em cerca de 23% dos casos. Na mola parcial é predominantemente, pequeno para a idade gestacional, salvo quando houver feto vivo em evolução.
Para que o útero seja considerado maior que o esperado para o período de amenorréia de vê ter volume correspondente a mais de 4 semanas de idade.
O excessivo volume da matriz é considerado fator de risco na evolução pós-molar.
Hiperêmese.
Costuma ser descrito como um dos sintomas mais freqüentes da mola conquanto haja estado presente em apenas 32% dos casos estudados de Goldstein & Berkowitz9 e em 32% daqueles de Kohorn. Decorre de intensas alterações endócrinas, sendo comum a presença de náuseas e vômitos incoercíveis levando a paciente ao emagrecimento e desidratação.
Toxemia precoce.
É também descrita como sinal clássico da prenhez molar. Mostrou-se em 27% das pacientes de Goldstein & Berkowitz e em 12% das pacientes de Curry et al. É infreqüente exibir-se a tríade sintomática: hipertensão, edema e proteinúria devendo-se o fato, talvez, ao diagnóstico precoce da mola e ao surgimento tardio da manifestação toxêmica. Não obstante, quando presente no início da gravidez, notadamente se acompanhada de perda sangüínea, deve suscitar, de imediato, o diagnóstico de mola.
Cistose ovariana.
Uni ou bilateral, conforme mostra a figura 5, é resultante da estimulação de hCG sobre a teça dos ovários, . Esteve presente em 20% dos casos de Kohorn, sendo, entretanto, mais freqüente na experiência de Goldstein & Berkowitz e outros. Sua incidência é mais baixa nos casos de mola parcial, muito embora haja tendência a encontrá-la com maior freqüência quando a propedêutica incorpora a ultra-sonografia.
Devido à presença mediana do útero volumoso, torna-se difícil a identificação dos cistos, assim à palpação abdominal como ao exame pélvico. Santos Ramos et al. (cit in Hill) conseguiram discernir ultra-sonograficamente os cistos tecaluteínicos dos ovários em aproximadamente 14% das neoplasias trofoblásticas gestacionais, quando em exame clínico conseguira identificá-la em apenas 10% das pacientes. Conseqüentemente, o exame ultra-sonográfico torna-se indispensável para monitorar a cistose ovariana e acompanhar a sua involução espontânea, fato que naturalmente ocorre após o esvaziamento uterino.
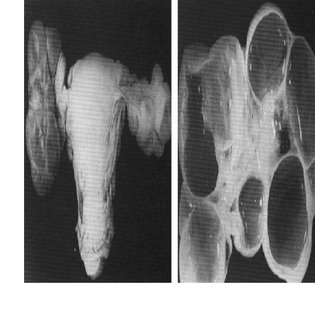
Figura 5. Cistose ovariana. Peça retirada em virtude de uma torção ovariana unilateral. Perceber a natureza dos cistos ovarianos gigantes no pormenor à direita. Imagem do Centro de Neoplasia Trofoblástica Gestacional .
DiagnósticoPoderá ser tanto clínico ou proveniente do auxílio de exames complementares.
Diagnóstico ClínicoO diagnóstico clínico deve ser sempre priorizado sobre os demais uma vez que leva em conta apenas o tirocínio do médico, hoje tão subjugado às modernas técnicas de diagnóstico através de propedêutica que, não obstante sua importância, deve ser complementar, como o próprio nome o diz.
O diagnóstico clínico deve ser feito mediante a anamnese e o exame obstétrico.
A história clínica deve buscar amenorréia, ausência de movimentos fetais, hemorragias e sangramentos indolores intercalados por corrimento branco ou amarelados, com cheiro forte, conseqüência da ruptura de uma ou mais vesículas, crescimento acentuado do útero, eliminação de vesículas, sinais e sintomas de toxemia e hiperêmese gravídica.
Levando em consideração a característica da hemorragia, temos que esclarecer uma certa variedade na sua manifestação. Nos cinco primeiro meses, pode aparecer como um tipo de “borra de café”, tornando-se, em seguida, abundante a tal ponto podendo até causar queda da pressão arterial, embora em geral a hemorragia seja pouca e persistente, durante dias, semanas ou meses. Quando se aproxima a fase de expulsão da mola, o sangramento pode se tornar abundante.
No exame obstétrico deverá ser realizada inspeção onde se espera encontrar ausência de movimentos fetais nos casos de mola completa, possíveis de perceber nos casos raros de mola e feto normal; na palpação, a indicação molar seria o útero grande para a idade gestacional, com consistência amolecida, ausência de contrações de Braxton-Hichs, ausência de partes fetais, contorno uterino uniforme, rechaço negativo e ovários muitas vezes aumentados e sensíveis.
A ausculta mostrará ausência de batimentos cardiofetais, mesmo com auxílio de sonar doppler, exceto nos casos de mola embrionada. No toque vaginal, por fim, chama a atenção a formação precoce do seguimento inferior e o amolecimento da cérvice, a zona cervical apresenta-se pastosa e o fundo de saco anterior torna-se proeminente, percebe-se a cistose ovariana como abaulamentos laterais ao útero, doloroso à pressão.
Diagnóstico laboratorialA presença de gonadotrofina coriônica na urina e no plasma das pacientes com NTG, produzida pelo trofoblasto, associada à ausência de batimentos cardíacos do feto na mola completa, a sintomatologia descrita e as imagens características proporcionadas pela ultra-sonografia, selam o diagnóstico.
Na mola parcial, ao revés, a identificação precoce, antes do esvaziamento uterino, é omitida em cerca de 90% das pacientes ao se confundir com o abortamento retido ou o incompleto.
É a dosagem de hCG fundamental assim para comprovar o diagnóstico como no acompanhamento pós-molar.
Atualmente a dosagem é feita pelo método de quimioluminescência automatizada que detecta teores muitos baixos do hormônio, imperceptíveis quando usados métodos biológicos e imunológicos.
Utilizando esse método de leitura sensível e específico para a dosagem das gonadotrofinas, consegue-se caracterizar a presença da fração beta, frustrando-se, assim, reação cruzada com o LH hipofisário.
Experiência do Centro Brewer de Doença Trofoblástica com o seguimento de 741 pacientes, mediante dosagens seriadas de βhCG, mostrou haver regressão espontânea do hormônio em 596 (80,8%) pacientes. Entre essas ocorreu negativação no 10º dia após esvaziamento uterino em 1,8%, entre 31 e 30 dias em 20,8%, entre 31 e 60 dias em 42,8% e entre 61 e 170 dias em 34,6%. Cumpre salientar que as 20% das pacientes apresentaram níveis elevados de βhCG após 60 ou mais dias de esvaziamento uterino, sugerindo a presença de tecido trofoblástico funcionante. Somente 10% das pacientes com níveis elevados a 60 dias desenvolveram posteriormente mola invasora ou coriocarcinoma.
Diagnóstico Ultra-SonográficoHavendo sangramento no primeiro trimestre de gestação, solicitar, sistematicamente, exame ultra-sonográfico.
É, na atualidade, segundo Tourinho, a ultra-sonografia o método propedêutico mais prático e eficiente para confirmar o diagnóstico de neoplasia trofoblástica. Demais de oferecer subsídios iconográficos, alguns típicos, o método mostra-se de grande utilidade, também, no diagnóstico da cistose ovariana e no acompanhamento de sua regressão espontânea, na visualização dos processos infiltrativos miometriais e das metástases de alguns órgãos abdominais, do fígado em especial.
Os elementos sonográficos que caracterizam a neoplasia devem ser buscados no útero e em outras estruturas, não havendo, de hábito, alterações significativas e típicas antes da 31ª de amenorréia. Os achados nessa fase são freqüentemente interpretados como restos ovulares, abortamento retido ou ovo anembrionado. Há relatos que após três semanas de evacuação de útero com um mínimo de área com padrão ecogênico central sem vesículas visíveis, tem-se como método de diagnóstico precoce de invasão miometrial (doença trofoblástica invasiva) a dopplerfluxometria colorida.
Mola CompletaNa sua expressão típica, a mola hidatiforme se caracteriza pelo útero grande para a idade gestacional, exibindo na cavidade numerosos ecos amorfos aos quais, de entremeio, misturam-se formações arredondadas, anecóicas, de tamanho variado, indicativas das vesículas. São as vesículas, no curso do primeiro trimestre, pequenas (2mm na 8ª semana) pelo que passam, maioria das vezes, despercebidas, tornando-se progressivamente maiores (10mm ou mais em derredor da 18ª semana) e, em conseqüência, de fácil demonstração, conforme mostra figura 6. Sangue acumulado na cavidade uterina, resultante de hemorragia, pode imprimir modificações no quadro sonográfico descrito.

Figura 6. Ultra-sonografia de mola completa. Imagem do Centro de Neoplasia Trofoblástica Gestacional.
Mola ParcialOs seguintes achados sonográficos na mola parcial são relatados na literatura e sancionados pela experiência: placenta extensamente aumentada; espaços císticos no seu interior; cavidade amniótica que tanto pode estar vazia, como conter ecos fetais ou então albergar concepto vivo, porém, com retardo de crescimento. Diversas e óbvias malformações fetais têm sido encontradas na mola parcial, susceptíveis de diagnosticadas ultra-sonograficamente.

Figura 6. Ultra-sonografia na mola parcial. Imagem do Centro de Neoplasia Trofoblástica Gestacional.
Mola Invasora
A mola invasora penetra no miométrio sendo a invasão passível de diagnosticada ultra-sonograficamente. Kobayashi e Viggiano et al descrevem as lesões intramurais como estrutura arredondada, de tamanho variável, de paredes bem delimitadas, fortemente eco-refringente e com uma área central também de tamanho variável, sonolucente. Chamam tais lesões, pela similitude “olho de coruja”. Encontra-se na intimidade do miométrio de útero aumentado e sub-involuído.

Figura 8. Ultra-sonografia de mola invasora. Imagem do Centro de Neoplasia Trofoblástica Gestacional.
Conduta na mola hidatiforme
Identificada a NTG cumpre, quase instantaneamente, proceder ao esvaziamento uterino que melhor será feito mediante vácuo-aspiração, mostarda na figura 9. Tal procedimento é quase destituído de risco de perfurar a matriz como de propiciar embolização do tecido trofoblástico, particularmente quando monitorado ultra-sonograficamente. Completada a aspiração é de boa norma realizar-se raspado-biópsia do endométrio a fim de obter informação histopatológica da reação do hospedeiro à ação invasora do trofoblasto.
Figura 9. Vácuo-aspiração.
As frações de tecido devem ser enviadas separadamente para exame anatomopatológico. Seria idea

l que, demais da histopatologia fosse realizado o exame citogenético, visando a confirmar o diagnóstico de mola hidatiforme parcial ou completa.
Não se aceita, modernamente, o esvaziamento uterino, mediante histerotomia, salvo em circunstâncias absolutamente singulares, quando não se dispuser de vácuo-aspiração. O que se observa na prática clínica é a histerotomia praticada de forma iatrogênica, extirpando a matriz uterina e comprometendo o desempenho reprodutivo futuro das pacientes, demonstrado na figura 10.
Figura 10. Histerotomia na mola hidatiforme.
Em raras oportunidades de mola parcial com feto vivo, a termo, ou surgindo complicações, hemorragia ou toxemia grave, deverá ser feita cesárea.
A presença de feto, na mola parcial, poderá dificultar a conduta clínica. Não é esse o caso estando ele morto ou sendo pequeno; ao revés, na prenhez avançada associa-se, com freqüência, à toxemia gravídica, hipertireoidismo, à hemorragia exigindo rápida intervenção que, em tais casos, será provavelmente histerotomia ou histerectomia, particularmente tratando-se de pacientes idosas ou de grandes multíparas.
Ocasionalmente pode a mola ser descoberta por ocasião do exame ultra-sonográfico rotineiro estando presente feto vivo e aparentemente normal. Em tais circunstâncias cumpre aguardar a evolução espontânea da gestação, pelo menos até a vitabilidade, a não ser que sobrevenham complicações a exigir sua imediata interrupção.
Alternativa para esvaziar o conteúdo molar será a administração de ocitócicos até expulsão substancial da mola e redução do volume uterino, quando, então, proceder-se-á à dilatação e curetagem (D & C) desde que o útero se haja tornado suficientemente pequeno para não oferecer risco de perfuração.
Quando, em certas ocasiões, prosseguir o quadro hemorrágico, repetir o esvaziamento uterino, rodada uma semana. O esvaziamento uterino deve ser sempre seguido da administração de ocitócicos e ergóticos, pelo tempo que se fizer necessário.
Goldstein & Berkowitz advogam a quimioterapia profilática contemporânea do esvaziamento uterino nos casos de mola de alto risco, partindo do pressuposto que a mola hidatiforme completa tem potencialidade localmente invasora ou para deportar o trofoblasto à distância. Segundo os autores ocorre invasão uterina local, após esvaziamento uterino, em 14% e surgem metástases em 4% das pacientes.
Adotando semelhante conduta em 858 pacientes portadoras de mola hidatiforme completa no Centro de neoplasia Trofoblástica Gestacional de New England, 31% exibiram sinais de invasão local e 8,8% desenvolveram metástases. Ao revés, pacientes que não exibem sinais de crescimento trofoblástico acentuado têm menor risco de vir a ter doença trofoblástica persistente. A invasão local, após esvaziamento uterino, foi registrada em apenas 3,4% dessas pacientes e metástases em 0,6%.
Concluído o diagnóstico, cumpre estadiar clínico-patologicamente a doença, visando à adoção de protocolo que melhor se preste ao seu tratamento.
Estadiamento ClínicoConquanto existam várias classificações na literatura, ressalto a de Sung –1981 (apud Grillo et al) apresentada por ocasião do Congresso Mundial da Federação Internacional de Ginecologia e Obstetrícia (FIGO) em Cingapura (1991), sofrendo algumas modificações pelo Comitê de Oncologia desta entidade, sendo a partir disso recomendada pela Sociedade Brasileira de Neoplasia Trofoblástica Gestacional e a seguir transcrita.
Estádio I – Doença limitada ao útero, conforme exibem as figuras 11 e 12.

Figura 11 (à esquerda). Ultra-sonografia de tumor trofoblástico gestacional. . Imagem do Centro de Neoplasia Trofoblástica Gestacional.
Figura 12 (à direita). Macroscopia de tumor trofoblástico gestacional estádio I. Imagem do Centro de Neoplasia Trofoblástica.
Estádio II – Tumor trofoblástico ultrapassando os lindes do útero, permanecendo, porém, confinado às estruturas genitais (anexos, vagina e ligamento largo), exemplificado pelas figuras 13 e 14.

Figura 13 (à esquerda). Tumor trofoblástico gestacional estádio II, metástase vaginal. Imagem do Centro de Neoplasia Trofoblástica Gestacional.
Figura 14 (à direita). Tumor trofoblástico gestacional estádio II, metástase cervical. Imagem do Centro de Neoplasia Trofoblástica Gestacional.
Estádio III – Tumor se estendendo aos pulmões, com ou sem envolvimento do sistema genital, como mostram as figuras 15 e 16.
Estádio IV – Tumor metastático em outros sítios, notadamente cérebro, sistema gastro-intestinal (fígado e baço), consoantes as figuras 17 e 18.

Figuras 15 e 16. Tumor trofoblástico gestacional estádio III. Imagem do Centro de Neoplasia Trofoblástica Gestacional.

Figuras 17 e 18. Tumor trofoblástico gestacional estádio IV metástase cerebral (à esquerda), e metástase hepática (à direita). Imagem do Centro de Neoplasia Trofoblástica Gestacional.
Os fatores de risco que influenciam o estadiamento são:
Teor inicial de β hCG urinário superior a 100.000 UI/L/24h ou plasmático, medido por radioimunoensaio, acima de 40.000 mUI/mL.
Duração da doença maior que 6 meses desde o término da gravidez antecedente
Além desses fatores de risco, devem ser considerados os seguintes aspetos:
Quimioterapia administrada anteriormente para tumor trofoblástico gestacional conhecido.
Tumor Trofoblástico do Sítio Placentário deve ser referido separadamente.
Torna-se desnecessária a comprovação histopatológica da doença.
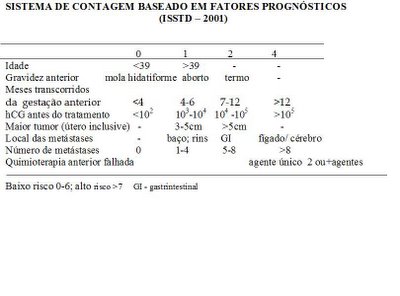
Em 1988, a Organização mundial da Saúde (OMS) propôs um sistema de “score” prognóstico para os tumores metastáticos baseado nos seguintes critério de risco: idade, tipo de gestação precedente, intervalo de tempo entre a gestação antecedente e o diagnóstico de NTG, nível de β hCG, maior massa tumoral, local e número de metástases e falha de quimioterapia prévia.
Um valor de 0 a 4 é aplicado para cada critério de risco e a somatória desses valores resulta na pontuação que classifica a paciente em baixo e alto risco, conforme mostra a Tabela 1.

Os exames necessários para o rastreamento e a classificação de Neoplasia Trofoblástica Gestacional são:
a) Exame ginecológico à procura da lesão vinhosa nos órgãos genitais externos e na vagina, avaliação do tamanho do útero e da sua consistência e procura de cistos tecaluteínicos;
b) Ultra-som pélvico com doppler para investigar o acometimento intra miometrial e os cistos ovarianos e
c) Radiografia de tórax para analisar se existem metástases pulmonares.
Esses três exames são iniciais e identificam a classificação na maioria das NTGs. O ultra-som hepático e a tomografia computadorizada cerebral, pelo custo-benefício, são realizadas apenas em casos selecionados de NTG. O fígado e o cérebro são locais mais tardios de metástases, e nas pacientes com seguimento pós-molar adequado, o diagnóstico de malignidade é precoce tornando o ultra-som hepático e a tomografia computadorizada desnecessários num primeiro momento, reservando-se esses exames para casos de NTG de longa duração e/ou com falha na quimioterapia.
Seguimento Pós-MolarApós a avaliação inicial e o estadiamento, tem início o seguimento que deve ser sistemático, pontual e rigoroso, consistindo de:
Exame pélvico com intervalos semanais, quinzenal e mensais até remissão definitiva.
Dosagem plasmática de gonadotrofina coriônica (subunidade beta) com intervalos semanais após o esvaziamento uterino, até obtenção de três dosagens consecutivamente negativas (remissão temporária). Prosseguir com intervalo quinzenal (uma dosagem) e, então, mensal até complementar seis meses após o primeiro resultado negativo quando houver remissão espontânea e um ano quando a paciente foi submetida à quimioterapia. A curva padrão de decaimento das gonadotrofinas coriônicas obedece ao gráfico proposto por Schlaerth et al., conforme é exibido abaixo no gráfico 1.

Radiografia dos campos pleuro-pulmonares com intervalos quinzenais até alcançar remissão. Daí em diante, radiografia mensal.
Anticoncepção deve ser iniciada imediatamente após o esvaziamento uterino. Conquanto controverso, deve dar-se preferência aos contraceptivos hormoniais orais, de baixa dosagem.
Expectativa de cura espontânea enquanto se mantiver regressiva a curva de eliminação das gonadotrofinas coriônicas, independente do tempo transcorrido desde o diagnóstico. Não ocorrendo, ou quando os níveis de β hCG nivelarem em duas dosagens consecutivas ou se elevarem e, surgindo metástases, deve ser iniciado o tratamento.
RemissãoA remissão espontânea ocorre em 80% dos casos de NTG5, curando-se, portanto, espontaneamente. Os demais evolvem para as formas invasoras, seqüelas proliferativas e/ou malignização.
É considerada remissão espontânea quando preenchem os seguintes requisitos:
Os níveis de gonadotrofinas decrescerem progressivamente e negativarem;
Houver rápida melhora no estado geral;
Involução uterina imediata e cessação das hemorragias;
Ausência ou involução espontânea da cistose ovariana com retorno da atividade cíclica;
Ausência de infiltração ou de metástases.
Vale ressaltar que uma vez que a cistose ovariana regride espontaneamente, está formalmente contra-indicada a laparotomia para a sua remoção cirúrgica, salvo quando sobrevier quadro de abdome agudo por complicações das tumorações ovarianas.
Histerectomia Total ProfiláticaO papel atual da cirurgia na Neoplasia Trofoblástica Gestacional reside na histerectomia total profilática estando indicada a pacientes com mais de 40 anos, multíparas tendo pelo menos três filhos e as portadoras de cistos tecaluteínicos volumosos, bilaterais dos ovários associados à útero grande para a idade gestacional.
Rocha concorda com a colocação acima e acrescenta: hemorragias uterinas incoercíveis ou de repetição, resistência à quimioterapia, infecção incontrolável ameaçando a vida da paciente, raros casos de necrose uterina induzida pela quimioterapia.
Quando se praticar histerectomia profilática nos casos de risco, não se omitirá a quimioterapia per-operatória. Assim procedendo, ficará reduzido o número de séries de quimioterapia a ser empregada, vez estar provado que a remoção do útero e de seu conteúdo molar acelera e antecipa a remissão definitiva.
Barcellos6, em quadro comparativo entre PSTT (Tumor Trofoblástico do Sítio Placentário) e Coriocarcinoma, demonstra que o primeiro apresenta boa resposta à histerectomia e o segundo não, mostrando com isso que a histerectomia profilática nem sempre representa a resolução de uma mola complicada.
Quimioterapia ProfiláticaConsoante sugerido por Goldstein & Berkowitz, a quimioterapia profilática pode ser empregada nos casos de mola hidatiforme completa de risco, podendo ser igualmente utilizada, como é o caso em nosso meio, nas pacientes cujo seguimento se mostre improvável e, em particular, quando se apresentarem os seguintes fatores de risco:
Níveis de gonadotrofinas coriônicas maiores que 100.000 UI/L/24h urinário ou 40.000 mUI/mL de plasma antes do esvaziamento uterino.
Útero grande para a idade gestacional.
Cistose ovariana maior que 6cm.
Idade materna superior a quarenta anos.
Histopatologia: trofoblasto compacto, infiltração linfoplasmocitária e depósito de fibrinócitos escasso ou ausente; classificação de Hertig e Mansell “potencialmente maligna”.
Mola de repetição.
Hipertireoidismo.
Toxemia precoce.
Embolização trofoblástica.
A quimioterapia profilática deverá ser iniciada simultaneamente ou imediatamente após o esvaziamento uterino, consoante os regimes consagrados.
EPÍLOGO- Do exposto, fica claro ser enormes as repercussões clínicas e sociais das neoplasias trofoblásticas gestacionais. Algumas conclusões, assim, podem de pronto ser obtidas.
- Quanto mais precoce for o diagnóstico, melhor é o prognóstico da paciente. Daí a importância de cada vez mais ser esta moléstia estudada pelos obstetras, ultra-sonografistas e aqueles que lidam com medicina de urgência, obstetras ou não.
- Deve a mola hidatiforme figurar no diagnóstico diferencial das hemorragias de primeiro trimestre, notadamente se presentes os elementos clínicos característicos da doença: útero grande para a idade gestacional, toxemia precoce, cistose ovariana, hiperêmese gravídica, edema e, notadamente, hemorragia.
- O esvaziamento uterino deveria ser feito, estando estável a paciente, no Centro de Referência, pelo dispor de vácuo-aspirador elétrico e recursos anátomo-patológico que serão importantes para estudar a mola hidatiforme. Nos casos de urgência, havendo sangramento vultuoso, deve a curetagem uterina ser realizada com extremo cuidado, pelo estar a matriz uterina amolecida e, com isso, evitando sua perfuração.
- O elemento mais fidedigno no seguimento pós-molar é a avaliação das gonadotrofinas coriônicas humana, marcador biológico, hormonial e tumoral, sensível em diagnosticar invasão miometrial ou mesmo coriocarcinoma.
- O tratamento das formas malignas e metastáticas dos tumores trofoblásticos gestacionais é feito mediante emprego da quimioterapia, notadamente dos regimes que contemplam o methotrexate, a actinomicina-D e a poliquimioterapia com EMA/CO. Em casos excepcionais, pode a quimioterapia profilática e a histerectomia adjuvante fazer parte do seguimento.
- Por fim, reafirma-se que é no centro especializado que se dá a melhor forma de seguimento pós-molar, devendo ser as pacientes encaminhadas no momento do diagnóstico a fim de ter aumentadas suas chances de sobrevida com qualidade de vida.